求電子剤
求電子剤(きゅうでんしざい、英: electrophile)あるいは求電子試薬(—しやく)、求電子種(—しゅ)とは、異なる化学種の間で電子の授受をともないながら化学結合を生成する反応において、電子を受け取る側、奪う側の化学種を指す、有機化学などで使われる用語である。
これに対し、電子を与える側の化学種は求核剤(nucleophile)と呼ばれる。
名称
[編集]「electrophile」という呼称は「nucleophile」とともに、クリストファー・ケルク・インゴールドにより提唱された。かつて日本では「electrophile」の訳に親電子の語が当てられた為に親電子剤と呼ばれることもある。求電子剤を機構の説明で図示する際に、その英語名から E と略される。
概要
[編集]求電子剤は、反応する対象となる求核剤の、電子密度の高い部位に対して攻撃を行う。有機反応の多くは電子対の授受であるため、その場合は求電子剤をルイス酸と見なすこともできる。
求電子剤には、陽イオン(H+、NO+
2 など)、分極により陽性を帯びた部位を持つ中性分子(HCl、各種ルイス酸、ハロゲン化アルキル、カルボン酸ハロゲン化物、カルボニル化合物 など)、求核種の接近により分極が誘起される分子(Cl2、Br2 など)、酸化剤(過酸 RC(=O)OOH など)、オクテット則を満たさないカルベンやラジカルやほかの分子(BH3、DIBAL など)、などが含まれる。
求電子性と酸性について
[編集]求電子剤の反応性の強弱を求電子性(きゅうでんしせい、electrophilicity)と呼ぶ。ある化学反応を考えるにあたり、ある化学種について「求電子性が大きい」というときは、反応相手(求核剤)の電子に対する親和性が高く反応速度が大きいことを示している。例として下図の反応で説明する。
E+ = 求電子剤、Nu- = 求核剤、k = 反応速度定数
このような反応で、「E+ の求電子性が大きい」というときは、「k が大きい」ことを示している。
求電子性の大小は、陽電荷の強さ(イオン価数ではなく実効電荷強度)だけではなく、電子を共有することで生成あるいは改変される分子軌道の(求電子剤側であれば多くの場合 LUMO の)エネルギー準位や立体因子などによっても決定される。それらが、遷移状態における活性化自由エネルギーの大小を決め、反応速度を決定付けるためである。HSAB則はある求核剤に対する求電子剤の反応性を半経験的に定式化したもので、反応相手の求核性に応じて変化する求電子性の大小を予測・評価する指標となる。
一方、酸の強弱を表す指標として酸性(さんせい、acidity)という用語が存在する。これは酸塩基反応の反応生成物が平衡状態においてどの程度の割合で生成するかという比率を表している。例として下図のルイス酸-塩基の反応で説明する。
A = ルイス酸、:B = ルイス塩基、
k = 正反応(錯体形成、会合)の反応速度定数、k-1 = 逆反応(解離)の反応速度定数
Ka = k / k-1 (平衡定数、会合定数)(k, K の小文字、大文字に注意)
このような反応で、「A の酸性が大きい」というときは、「Ka が大きい」ことを示している。
酸性度は、平衡状態における基質と生成物との存在比に基づくため、正反応と逆反応の速度定数の比、すなわち平衡定数(会合定数)の大小で評価される。逆反応を考えなければならない点が、求電子性の評価の場合と大きく異なる。特に立体障害の大きい化学種などでは、正反応と逆反応がともに遅くなるため、求電子性(反応速度)が小さい求電子剤において酸性度も小さいとは限らない。そのような見地からすると上図のような錯体形成の場面においては求電子性は結合生成の速度論支配の因子(Kinetic factor)であり、酸性度は熱力学支配の因子(Thermodynamic factor)となる。
ブロンステッド酸(H+ を与える酸)の場合の酸性度は、共役塩基との酸塩基平衡反応と、そこでの酸解離定数 (例:Ka = [A-][H+] / [AH])を用いて同様に考える。
有機化学における求電子剤
[編集]求電子付加はアルケンが起こす主要な反応のうちの1つである。
- ハロゲンや硫酸による求電子付加
- 酸存在下、水分子付加によるアルコールの生成
- チーグラー・ナッタ触媒による重合
シクロプロパン環も、求電子付加を受けやすい基質である。
- 混酸(硝酸+硫酸)によるニトロ化反応
- 硫酸によるスルホン化反応
- フリーデル・クラフツ反応
付加
[編集]アルケンに対して求電子付加を起こす求電子剤の代表例として、ハロゲン(Br2、I2 など)、ハロゲン化水素(HCl、HBr など)が挙げられる。それらの付加反応を例にとり、生成物と、求電子付加反応の代表的な機構とをあわせて示す。
臭素の付加
[編集]アルケンに臭素 (Br2) が求電子付加すると、1,2-ジブロモアルカンを与える。例えば、エチレンに臭素が付加すると、1,2-ジブロモエタンが得られる。この反応は、以下のような機構で段階的に進行する[1]。
- 臭素がアルケンに接近し、π錯体 1 を形成する。
- アルケンの2つの炭素と臭素原子1個から、三員環状のブロモニウムイオン 2 ができる。
- 前の段階で付加した臭素とは反対側の方向から、臭化物イオンなどが攻撃して生成物のジブロモ化合物 3 を与える。
3 の段階で生成物の立体化学が決まるため、通常の基質からはアンチ体(トランス体)のジブロモ化合物が得られる(アンチ付加 もしくは トランス付加)。また、水やアルコールなど、求核性を持つ化合物が溶媒などとして共存している場合、ブロモニウムイオン 2 に対してそれらの分子の付加が起こり、アルコールやエーテルなどが得られる。
この機構は、AdE2 機構と呼ばれ、ヨウ素 (I2)、塩素 (Cl2)、スルフェニルカチオン (RS+)、水銀イオン (Hg2+)、ジクロロカルベン (:CCl2) による付加反応においてもあらわれる。IUPAC表記法では AE+AN と表される。
- 補足
上記 1 の段階で、特に非極性溶媒中では、2分子、もしくは 3分子の臭素の付加体が介在する場合があることが、反応速度論的な検討から知られている。また、臭化物イオンが充分量共存している場合は、1 の段階から直接 3 の段階へ進む機構があらわれる。フェニル基など、カルボカチオンを安定化させる置換基を有する場合は、β-ブロモカルベニウムイオンを中間体として経由する機構が主となる場合がある。
- 中間体 2 について
三員環状のブロモニウムイオン 2 は、単離されて構造が決定された例(アダマンチリデンアダマンタンへの付加体など)がある[2]。この構造はβ-ブロモカルベニウムイオンの構造と共鳴の関係にあるため、正電荷は非局在化しており、非古典的カルボカチオンとも呼ばれてきた。
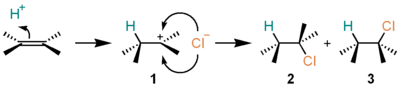
塩化水素の付加
[編集]アルケンに塩化水素 (HCl) が求電子付加すると、ハロゲン化アルキルを与える。例えば、エチレンに塩化水素が付加すると、クロロエタンが得られる。この反応は、以下のようなカルボカチオンを中間体とする機構で進行する。
- アルケンのいずれかの炭素にプロトン (H+) が付加し、もう一方の炭素を中心とするカルボカチオン 1 が発生する。
- カルボカチオン 1 と、塩化水素あるいは塩化物イオンが結合して生成物 2、3 を与える。
いったんカルボカチオン 1 を経由するため、生成物の立体選択性(2 と 3 の生成比)は反応の種類によってまちまちである。一方、非対称アルケンに対する付加の位置選択性(H、Cl が左右どちらの炭素に付加するかの比)は多くの場合マルコフニコフ則に従う。すなわち、より置換度の高いカルボカチオンが中間体となるように、置換度の低い炭素にプロトンが付加する。この機構は、A-SE2 機構と呼ばれ、E1脱離機構の逆の経路をたどって進行している。IUPAC表記法では AH+AN と表される。
- 補足
1 の段階において、ハロゲンの付加の場合に見られるような三員環状の中間体は生成せず、類似した構造の遷移状態を経てカルボカチオン 1 まで至ることが理論計算によって予想されている[3]。
フッ化水素 (HF)、ヨウ化水素 (HI) も塩化水素と同様な反応を起こす。一方、臭化水素 (HBr) は条件によってはラジカル付加反応が競争し、マルコフニコフ則に従わない生成物が得られる。ラジカル捕捉剤や相間移動触媒を用いることによってマルコニコフ型の付加物が、過酸化物などのラジカル開始剤の添加によって反マルコフニコフ型の付加物が、それぞれ選択的に合成できる。
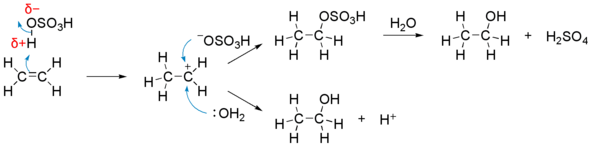
水付加
[編集]これはオレフィンより工業的にエタノールを製造する上で重要なプロセスである。この反応はより複雑で、硫酸などの酸を触媒として用いる。塩化水素の付加と同様に進行するが、 OSO3H 基が OH 基と置き換わってアルコールを与える段階が加わる。
硫酸は最終生成物には含まれないが反応に関与するため、間接的水和法とも呼ばれる。
反応の機構は以下のようなものである。
- 硫酸 (H−OSO3H) の水素原子が δ+ の電荷を帯び、上記の塩化水素の反応と同様にして二重結合にひきつけられ、反応する。
- 生成した −OSO3H イオンが炭素原子に付加し、硫酸水素エチルが生成する。
- 反応混合物に水 (H2O) を加えて熱するとエタノール (CH3CH2OH) が生成し、水から代わりの水素原子が与えられて硫酸が再生する。
この過程によって1分子の水が1分子のエチレンに付加し、エタノールとなる。中間体のカルボカチオンに対し、水分子が直接付加してエタノールに変わる経路も共存する。置換基を持つアルケンの場合はマルコフニコフ型付加物のアルコールが得られるが、中間体のカルボカチオンが転位した生成物を与えることもある(ワーグナー・メーヤワイン転位も参照)。
酢酸水銀(II) をアルケンに付加させたのち水素化ホウ素ナトリウムで処理すると、マルコフニコフ型付加物のアルコールが選択的に得られる。