フォトリアーゼ
フォトリアーゼ(Photolyase)(EC 4.1.99.3)は、紫外線に曝露されたことによって起こるピリミジン二量体の生成によるDNA損傷を修復するDNA修復酵素である。この酵素のメカニズムとして、可視光、特に可視光スペクトルの端の紫色や青色の光を優先的に必要としており、光回復酵素として知られている。
解説
[編集]
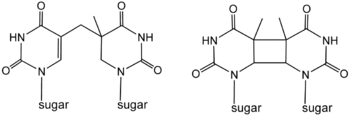
フォトリアーゼは、相補DNA鎖に結びつき同じDNA鎖上の隣り合ったチミンやシトシンの対が共有結合することによって生成するピリミジン二量体を分解する。これらの二量体はDNA構造に損傷と呼ばれる膨らみをもたらす。最も一般的な共有結合は、シクロブタン架橋を形成する。フォトリアーゼは、これらのDNA損傷に高い親和性を持ち、可逆的に結び付き、これらの損傷を元の正常な塩基に修復する。
フォトリアーゼは、フラボタンパク質であり、2つの集光補因子を含んでいる。すべてのフォトリアーゼは、2電子還元されたFADH-を含んでおり、これらのフォトリアーゼは2番目の補因子に基づいて葉酸フォトリアーゼのプテリン 5,10-メテニルテトラヒドロ葉酸とデアザフラビン(補酵素F420))フォトリアーゼのデアザフラビン(補酵素F420))8-ヒドロキシ-7,8-ジデメチル-5-デアザリボフラビン(8-HDF)の2つの主要なグループに分けることができる。FADのみが触媒作用に求められるが、2番目の補因子は低照度の環境で反応率を有意に高めている。光のエネルギーによって活性化され、ピリミジン二量体を分解する電子供与体として働く還元されたフラビンFADH-が電子を移動させることによってフォトリアーゼが機能する[1]。
フォトリアーゼは、バクテリア、菌類から動物にわたる多数の種に存在し機能している[2]。しかし、ヒトを含む有胎盤哺乳類では、フォトリアーゼに相当する酵素は遺伝子修復機能は失活しており、フォトリアーゼの類縁遺伝子(ホモログ)であるクリプトクロムのCRY1とCRY2がサーカディアンリズムの調整機能を担っている。これらの動物では、紫外線により生じた例えばチミン二量体による損傷のDNA修復は、ヌクレオチド除去修復により行われる。
系列の類似性に基づいてDNAフォトリアーゼは、2グループにまとめることができる。最初のグループは、グラム陰性菌、グラム陽性菌、好塩性古細菌、ハロバクテリウム(Halobacterium halobium)、菌類及び植物に由来するフォトリアーゼを含んでいる。このドメインのタンパク質は、青色光誘導遺伝子発現及びサーカディアンリズムの調整を仲介する青色光受容体であるシロイヌナズナのクリプトクロム1及び2(CRY1とCRY2)も含んでいる。
ある日焼け止め剤は、その成分にフォトリアーゼを含んでおり、紫外線ダメージスキンに修復作用があるとうたっている[3]。
このドメインを含むヒトのタンパク質
[編集]脚注
[編集]- ^ Sancar A. (2003). “Structure and function of DNA photolyase and cryptochrome blue-light photoreceptors”. Chem Rev 103 (6): 2203–37. doi:10.1021/cr0204348. PMID 12797829.
- ^ Selby, Christopher P.; Sancar, Aziz (21 November 2006). “A cryptochrome/photolyase class of enzymes with single-stranded DNA-specific photolyase activity”. Proceedings of the National Academy of Sciences of the United States of America 103 (47): 17696–700. doi:10.1073/pnas.0607993103. PMC 1621107. PMID 17062752.
- ^ Kulms, Dagmar; Pöppelmann, Birgit; Yarosh, Daniel; Luger, Thomas A.; Krutmann, Jean; Schwarz, Thomas (1999). “Nuclear and cell membrane effects contribute independently to the induction of apoptosis in human cells exposed to UVB radiation”. PNAS 96 (14): 7974–7979. doi:10.1073/pnas.96.14.7974. PMC 22172. PMID 10393932.