プロテアソーム
この記事は英語版の対応するページを翻訳することにより充実させることができます。(2021年3月) 翻訳前に重要な指示を読むには右にある[表示]をクリックしてください。
|
プロテアソーム (proteasome) はタンパク質の分解を行う巨大な酵素複合体である。プロテアソームは真核生物の細胞において細胞質および核内のいずれにも分布している[1]。ユビキチンにより標識されたタンパク質をプロテアソームで分解する系はユビキチン-プロテアソームシステムと呼ばれ、細胞周期制御、免疫応答、シグナル伝達といった細胞中の様々な働きに関わる機構である。この「ユビキチンを介したタンパク質分解の発見」の功績によりアーロン・チカノーバー、アブラム・ハーシュコ、アーウィン・ローズの3人が2004年ノーベル化学賞を受賞した。
プロテアソームは全ての真核生物と古細菌が有しているが、古細菌のものは真核生物に比べはるかに単純である。本稿では主に真核生物のプロテアソームについて解説する。
26Sプロテアソーム
[編集]
26Sプロテアソームは、プロテアーゼ活性を有する筒状の20Sプロテアソームにその蓋(ふた)のような役割を果たす19S複合体が2つ結合したもので、「ダンベル型」と呼ばれることもある。それに対して20Sプロテアソームの両端に11S複合体がそれぞれ結合したものは「フットボール型」と呼ばれる。
- 20Sプロテアソーム (CP:core particle)
- 20Sプロテアソームはα1~7の7分子から構成されるαリングと、β1~7の7分子から構成されるβリングが、αββαの順に積み重なった筒状構造をしている。空洞になった部分はタンパク質分解の場となっており、β1、β2、β5がそれぞれトリプシン様、キモトリプシン様、ペプチジルグルタミルペプチド加水分解(PGPH)活性という異なる触媒活性を発揮する[2]。通常20Sプロテアソーム単体の状態ではαリングが閉じており、基質が中に入ることはできない。20S proteasome分子集合には、PAC1, 2, 3, 4(Pba1, 2, 3, 4), Ump1の分子シャペロンにより、正しく形成される。
- 19S複合体 (RP:regulatory particle, PA700)
- 筒状の20Sプロテアソームの両端に結合し、蓋のような役割を果たす。19S複合体はさらにbase(基部)とlid(蓋部)に分けられる。baseは Rpt1~6とRpn1~2の計8分子のタンパク質から構成され、20Sプロテアソームのαリング開口制御、標的タンパク質のアンフォールディングに関わっている。lidはRpn3,5~9,11,12の計8分子のタンパク質から構成されており、脱ユビキチン化反応に関わっている。また、baseとlidのつなぎ目にはRpn10サブユニットがあり、蝶番(ちょうつがい)的な役割並びに標的タンパク質の認識・捕捉に関わっている。
- 11S複合体(PA28)
- 11S複合体は上記の19S複合体と同様に20Sプロテアソームの両端に結合する能力を有する8量体である。ATPase活性を有するサブユニットは含まず、短いペプチドの分解に寄与する。
免疫プロテアソーム
[編集]ウイルス感染などによりIFNγが産生されると、これに応答してβ1i、β2i、β5iの3種類のサブユニットが誘導される。これらは20Sプロテアソームのβ1、β2、β5と入れ替わり、すなわちプロテアーゼ活性部位がそっくり入れ替わり、免疫プロテアソームと呼ばれるプロテアソームを形成する。
また、IFNγはPA28(proteasome activator) 複合体を誘導する。このPA28複合体は19S複合体と同様に20Sプロテアソームと結合する。分解されたペプチド断片の排出を促進することがその役割と考えられており、19S複合体-20S免疫プロテアソーム-PA28複合体の3つにより形成されたプロテアソーム(ハイブリッドプロテアソーム)はMHCクラスIにより抗原提示される際に都合の良いペプチド断片を生じると考えられている。
タンパク質分解メカニズム
[編集]ユビキチン-プロテアソームシステムの大まかな流れ
[編集]
- 標的タンパク質がユビキチンにより標識される。詳しくはユビキチンを参照。
- 標的タンパク質に結合したユビキチン鎖が19S複合体に結合する。
- 標的タンパク質からユビキチン鎖を切り離す。切り離されたユビキチンは再利用される。
- 標的タンパク質の立体構造を解き(アンフォールディング)、20Sプロテアソーム内に送り込む。
- βリング内部のプロテアーゼ活性により標的タンパク質は分解される。
ユビキチン非依存的なタンパク質分解
[編集]プロテアソームによるタンパク質分解はほとんどの場合ユビキチンによる標識を必要とするが、必ずしもそうではない。例外として最もよく知られている分子がオルニチンデカルボキシラーゼ(ODC)である[3]。細胞周期の制御に関与しているp53もユビキチン非依存性の分解経路が存在するが、この分子はユビキチン依存的な分解が行われる[4]。
プロテアソームによる分解の意義
[編集]プロテアソームと同じく細胞内蛋白質の分解を司るものとしてリソソームが知られているが、リソソームは蛋白質を分解して他の新しい蛋白質を合成するための材料を供給することを目的としているのに対し、プロテアソームは目的蛋白質を特異的に分解し、細胞内から除去することを目的としている。
プロテアソームを介した細胞周期・シグナル伝達の制御
[編集]プロテアソームは細胞周期・シグナル伝達の制御においても重要な役割を果たしている。以下にその具体例を示した。
Nuclear factor κB(NF-κB)経路の活性化
[編集]転写因子NF-κBは炎症関連遺伝子の活性化に関与するタンパク質である。そのアミノ酸配列中には核内移行シグナル(nuclear localization signal;NLS)を有しているが、通常はinhibitor of κB(IκB)によりNLSがマスクされているため細胞質に保持されている。しかし、何らかの刺激(炎症性刺激、酸化ストレス等)が細胞に入ることによりIκBのリン酸化が生じるとIκBはユビキチン‐プロテアソーム系を介した分解を受ける。IkBが外れてフリーになったNF-κBは核内移行した後にDNAとの相互作用により転写亢進を行う。
細胞周期におけるプロテアソームの関与
[編集]細胞周期の回転にはサイクリンとサイクリン依存性キナーゼ(CDK;cyclin dependent kinase)の複合体が重要な役割を担っている。細胞周期の回転はG1→S→G2→M期の順に進行し、例えばG1→Sの進行にはサイクリンE/CDK2が寄与している。G1期にはサイクリンEの発現が上昇して細胞周期の回転を進めるが、S期に入るとサイクリンEはリン酸化を受けプロテアソームにより分解を受けることが知られている。
また、上記とは反対にCDKのキナーゼ活性を阻害して細胞周期を負に制御するCDKインヒビター(p21、p27など)も、プロテアソーム依存的に分解されることで発現量の制御を受けるものが多く、サイクリン-CDKと協調して細胞周期の秩序だった進行やチェックポイント機構の制御に重要な役割を担っている。
細胞周期の回転に関与するユビキチンリガーゼとしてAPC/C(anaphase-promoting complex/cyclosome)とSCF(Skp1-cullin-F-box)が知られており、2大ユビキチンリガーゼといわれる。M期の細胞周期の回転にAPC/Cが関与しており、その他の時期にSCFが関与している。また、サイクリン/CDK2の抑制に働くp53の分解にMDM2(murine double minute2)が関与している。
HIF-1αの分解
[編集]転写因子である低酸素誘導因子 hypoxia inducible factor(HIF)-1αは低酸素状態において誘導される蛋白質である。HIF-1αは誘導型一酸化窒素合成酵素 iNOS(inducible NO synthase)や血管内皮増殖因子VEGF(vascular endothelial growth factor)等の転写促進に関与し、癌における血管新生などに関与しているが、正常酸素状態ではHIF-1αはプロリン残基が水酸化を受け、プロテアソームによる分解へ導かれる。
古細菌におけるプロテアソーム
[編集]現在調べられている全ての古細菌はプロテアソームを持つ。最初に構造が決定されたプロテアソームは、真核生物のものではなく、古細菌T. acidopilumのものであった。真核生物と同様、タンパク質分解を担っている。ユビキチンシステムの遺伝子も一部の古細菌から見出されているが、実態は不明である。
大まかな20Sプロテアソームの構造は真核生物型とほぼ同一である。ただしサブユニット構造ははるかに単純で、α分子ホモ7量体から構成されるαリングとβ分子ホモ7量体から構成されるβリングがαββαの4層に重なった構造をしている。また、26SプロテアソームはRpnを持たず、Rpt6分子よりなる蓋部を備えたTαββαTの様な構造をとることが明らかになっている。
なお、真正細菌ではアクチノマイセス目が古細菌のものに似たプロテアソームを有している。アクチノマイセス目は真正細菌のタンパク質分解システムも同時に備えており、なぜ真正細菌の中でアクチノマイセス目のみがプロテアソームを持っているのかは不明である。ただし、結核菌においては病原性に関与することが示されている。
プロテアソーム阻害薬
[編集]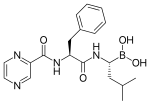
26Sプロテアソームを阻害するボルテゾミブが、血液癌の一種である多発性骨髄腫に有効であることが報告され、抗癌剤として臨床応用されている[5]。
出典
[編集]- ^ Peters JM, Franke WW and Kleinschmidt JA.(1994)"Distinct 19S and 20S subcomplexes of the 26S proteasome and their distribution in the nucleus and the cytoplasm."J.Biol.Chem. 269,7709–18. PMID 8125997
- ^ Heinemeyer W, Fischer M, Krimmer T, Stachon U and Wolf DH.(1997)"The active sites of the eukaryotic 20 S proteasome and their involvement in subunit precursor processing."J.Biol.Chem. 272,25200–9. PMID 9312134
- ^ Zhang M and Coffino P.(2004)"Repeat sequence of Epstein-Barr virus-encoded nuclear antigen 1 protein interrupts proteasome substrate processing."J.Biol.Chem. 279,8635–41. PMID 14688254
- ^ Asher G and Shaul Y.(2005)"p53 proteasomal degradation: poly-ubiquitination is not the whole story."Cell Cycle. 4,1015–8. PMID 16082197
- ^ Fisher RI, Bernstein SH, Kahl BS, Djulbegovic B, Robertson MJ, de Vos S, Epner E, Krishnan A, Leonard JP, Lonial S, Stadtmauer EA, O'Connor OA, Shi H, Boral AL and Goy A.(2006)"Multicenter phase II study of bortezomib in patients with relapsed or refractory mantle cell lymphoma."J.Clin.Oncol. 24,4867–74. PMID 17001068
