ディールス・アルダー反応
| ディールス・アルダー反応 | |
|---|---|
| 名の由来 | オットー・ディールス クルト・アルダー |
| 種類 | 環化付加反応 |
| 識別情報 | |
| Organic Chemistry Portal | diels-alder-reaction |
| RSC ontology ID | RXNO:0000006 |
ディールス・アルダー反応(—はんのう、英: Diels–Alder reaction)とは、共役ジエンにアルケンが付加して6員環構造を生じる有機化学反応であり、[4+2]環状付加とも言われる。1928年にドイツの化学者、オットー・ディールス (Otto Diels) とクルト・アルダー (Kurt Alder) によって発見された[1](1950年にノーベル化学賞受賞)。ジエン合成とも呼ばれる。ペリ環状反応のうち、付加環化反応のひとつ。
ディールス・アルダー反応の最も単純な例として、エチレンと1,3-ブタジエンの反応を挙げる。
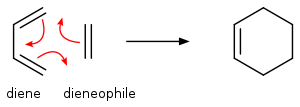
ディールス・アルダー反応について考えるとき、共役ジエンに対して反応するアルケン(上式ではエチレン)のことをジエノファイル(親ジエン体、英: dienophile、ジエノフィルとも)と呼ぶ。
反応機構
[編集]この反応の機構はフロンティア軌道理論やウッドワード・ホフマン則によって説明される。すなわち共役ジエンの最高被占軌道 (HOMO) とジエノファイルの最低空軌道 (LUMO) の間の相互作用によって2つの σ結合がそれぞれの分子のπ軌道面の同じ側(スプラ型)で協奏的 (concerted) に生成する反応である。
それゆえ、共役ジエンに HOMO のエネルギー準位を上昇させる電子供与性基、ジエノファイルに LUMO のエネルギー準位を低下させる電子求引性基が置換している場合に、2つの軌道の相互作用がより大きくなり反応が加速される。
それとはまったく逆に共役ジエンに強力な電子求引性基、ジエノファイルに強力な電子供与性基がついている場合も反応が加速される。この場合には共役ジエンの LUMO とジエノファイルの HOMO の相互作用で反応が進行していると考えられ、逆電子要請型ディールス・アルダー反応という。
またディールス・アルダー反応は熱によって反応が進行するが、光によっては進行しない(熱で許容、光で禁制)。図を用いて説明すると、基底状態では共役ジエンの HOMO はπ2軌道であるが、HOMO の電子が光によって励起すると励起状態では HOMO の軌道がπ3軌道となるため、ジエノファイルの LUMO との軌道の重なりがなくなるので相互作用しなくなるからである。

立体選択性
[編集]共役ジエンの1位と4位に置換基があり、ジエノファイルにも置換基がある場合のディールス・アルダー反応では複数の生成物が考えられ、速度論的支配の endo付加体と熱力学的支配の exo付加体が存在する。この場合の生成物の立体選択性は endo則 によって説明される。例えば、シクロペンタジエンとカルボニル基などのπ電子のある置換基を持つジエノファイルとの反応の場合、この置換基のπ軌道と共役ジエンのπ軌道との重なりによる二次軌道相互作用により、endo付加体が優先的に生成する。

しかし立体的な影響を大きく受けるため、反応基質によっては exo付加体が優先することもある。特に分子内ディールス・アルダー反応では、コンフォーメーションの自由度が低いために endo則が成立しない場合が多い。
その他
[編集]また、共役ジエンとジエノファイルの反応に関与する6つの原子の中にヘテロ原子を含む場合に起こるこの反応は、特にヘテロ・ディールス・アルダー反応と呼ばれる。
ディールス・アルダー反応は生物における反応でも最近になって数種類知られるようになった。そのうち「マクロフォミン酸合成酵素」で反応機構が詳細に調べられている[2][3]。ただしこの反応機構については異論もある[4]。また「人工酵素」(リボザイム、抗体酵素)を用いる試みも行われている。
温度が200度以上の場合、環状化合物が形成されなくなり、できた化合物はもとの反応物に戻る。これはこの反応の逆だから、レトロディールス・アルダー反応という。
参考文献
[編集]- ^ Diels, O. and Alder, K. (1928). “Syntheses in the hydroaromatic series. I. Addition of “diene” hydrocarbons”. Liebigs Ann. Chem. 460: 98.
- ^ Ose, T. et al. (2005). "Insight into a natural Diels−Alder reaction from the structure of macrophomate synthase". Nature 422: 185–189. doi:10.1038/nature01454
- ^ 世界初の天然型 Diels-Alderase (北海道大学)
- ^ Guimarães, C. R. W.; Udier-Blagovic, M.; Jorgensen, W. L. (2005). "Macrophomate Synthase: QM/MM Simulations Address the Diels-Alder versus Michael-Aldol Reaction Mechanism". J. Am. Chem. Soc. 127: 3577–3588. doi:10.1021/ja043905b
関連文献
[編集]- 犬飼孝、児島健志「Diels-Alder反応の機構」『有機合成化学協会誌』第26巻第7号、有機合成化学協会、1968年、537-550頁、doi:10.5059/yukigoseikyokaishi.26.537。
