ザンドマイヤー反応
| ザンドマイヤー反応 | |
|---|---|
| 名の由来 | トラウゴット・ザンドマイヤー |
| 種類 | 置換反応 |
| 識別情報 | |
| Organic Chemistry Portal | sandmeyer-reaction |
| RSC ontology ID | RXNO:0000021 |
ザンドマイヤー反応(ザンドマイヤーはんのう、英: Sandmeyer reaction)は、試薬または触媒として銅塩を用いて芳香族ジアゾニウムイオンからハロゲン化アリールを合成する化学反応である。ハロゲン化物やシアン化物に変換する反応である[1][2][3]。本反応はラジカル機構による芳香族求核置換反応の一例である。ザンドマイヤー反応によって、ハロゲン化、シアノ化、トリフルオロメチル化、およびヒドロキシ化といったベンゼンの特色のある変換を行うこと可能である。
本反応は1884年にスイスの化学者トラウゴット・ザンドマイヤー によって、塩化ベンゼンジアゾニウムと銅アセチリドからフェニルアセチレンを合成しようと試みた時に発見された。代わりに、ザンドマイヤーが単離した主生成物は塩化フェニルだった[4]。現代では、ジアゾニウム塩の調製と銅(I) 塩触媒存在下での続く求核剤による置換によって芳香族アミノ基を置換するための全ての方法をザンドマイヤー反応と呼ぶ(銅塩が低価格であるため、触媒量で反応が進行する時でさえも、よい反応性を求めるために化学量論量がしばしば用いられる)。最も一般的に使われるザンドマイヤー反応は、塩素化、臭素化、シアノ化、およびヒドロキシ化反応である。これらはそれぞれCuCl、CuBr、CuCN、およびCu2Oを用いる。より最近では、ジアゾニウム塩のトリフルオロメチル化反応が開発され、「ザンドマイヤー型」反応と呼ばれている。ジアゾニウム塩はホウ酸塩、ヨウ化物イオン、チオール、水、次亜リン酸などとも反応し[5]、フッ素化はテトラフルオロホウ酸陰イオンを用いることが行うことができる(バルツ・シーマン反応)。しかしながら、これらの工程は金属触媒を必要とするため、ザンドマイヤー反応とは大抵呼ばれない。これまで開発された数多くの変法では、銅(II)、鉄(III)、およびコバルト(III) を含む他の遷移金属塩も用いられてきた[6]。その幅広い合成的適用可能性のため、ザンドマイヤー反応とその他のジアゾニウム化合物の変換法は、芳香族求電子置換反応を補完する。
反応条件と反応機構
[編集]亜硝酸は通常亜硝酸ナトリウムと酸からin situで調製される。2回のプロトン化段階の後、1当量の水が失われてニトロソニウムイオンが形成される。ニトロソニウムイオンは次にアニリンのような芳香族(または複素環)アミンとの反応において求電子剤として働き、ジアゾニウム塩が形成される。これはニトロソアミン中間体を経て進行する[5]。典型的な反応条件を以下に示す[7][8]。
- 塩素化
- ArN2+Cl–, CuCl, HCl (36% aq.), 50 – 100 °C
- 臭素化
- rN2+HSO4–, CuBr, HBr (48% aq.), 50 – 100 °C
- シアノ化
- ArN2+Cl–, CuCN, KCN, H2O, benzene, 0 °C
- ヒドロキシ化
- Cu2O, Cu(NO3)2, H2O, 25 °C
ザンドマイヤー反応はラジカル機構による芳香族求核置換反応(SRNAr)の一例である。ザンドマイヤー反応のラジカル機構はビアリール副生成物の検出によって支持される[9]。芳香族ジアゾ基のハロゲンまたは擬ハロゲンによる置換は、銅(I) 塩によっ触媒される1電子移動機構によって開始され、窒素ガスが失われてアリールラジカルが形成される[10][11][12][9]。銅(II) 種からアリールラジカルへのCl、Br、CN、またはOHの直接的移動によって置換アレーンが生成される可能性がある(銅(I) 触媒が再生する)。代替提案では、アリールラジカルと銅(II) 種とのカップリングによって形成される一時的な銅(III) 中間体がすばやく還元的脱離を起こすことで、生成物が得られ、銅(I) が再生する[13][14][15]。しかしながら、こういった有機銅中間体についての証拠は弱く、主に状況証拠であり[16][17]、正しい経路は基質と反応条件に依存するだろう。これらの可能性を以下に示す。
ニトロソニウムイオンの形成
[編集]
ベンゾジアゾニウムイオンの形成
[編集]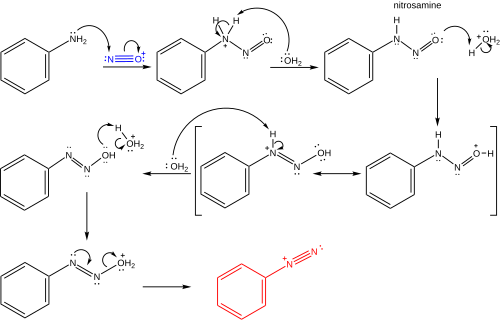
ザンドマイヤー反応
[編集]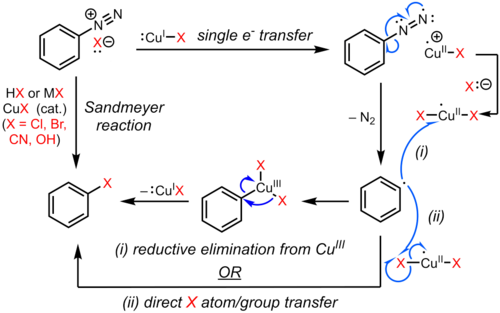
出典
[編集]- ^ Traugott Sandmeyer (1884). “Ueber die Ersetzung der Amidgruppe durch Chlor in den aromatischen Substanzen”. Berichte der deutschen chemischen Gesellschaft 17 (3): 1633–1635. doi:10.1002/cber.18840170219.
- ^ Traugott Sandmeyer (1884). “Ueber die Ersetzung der Amid-gruppe durch Chlor, Brom und Cyan in den aromatischen Substanzen”. Berichte der deutschen chemischen Gesellschaft 17 (4): 2650–2653. doi:10.1002/cber.188401702202.
- ^ Ludwig Gattermann (1890). “Untersuchungen über Diazoverbindungen”. Berichte der deutschen chemischen Gesellschaft 23 (1): 1218–1228. doi:10.1002/cber.189002301199.
- ^ Hodgson, Herbert H. (1947-04-01). “The Sandmeyer Reaction.”. Chemical Reviews 40 (2): 251–277. doi:10.1021/cr60126a003. ISSN 0009-2665.
- ^ a b Wang, Zerong (2010). “Sandmeyer Reaction” (英語). Comprehensive Organic Name Reactions and Reagents. John Wiley & Sons, Inc.. pp. 2471–2475. ISBN 9780470638859
- ^ M. P. Doyle, B. Siegfried and J. F. Dellaria (1977). “Alkyl nitrite-metal halide deamination reactions. 2. Substitutive deamination of arylamines by alkyl nitrites and copper(II) halides. A direct and remarkably efficient conversion of arylamines to aryl halides”. J. Org. Chem. 42 (14): 2426–2431. doi:10.1021/jo00434a017.
- ^ Chandler), Norman, R. O. C. (Richard Oswald (1993). Principles of organic synthesis.. Coxon, J. M. (James Morriss), 1941- (3rd. ed.). London: Blackie Academic & Professional. ISBN 978-0751401264. OCLC 27813843
- ^ Cohen, Theodore; Dietz, Albert G.; Miser, Jane R. (1977-06-01). “A simple preparation of phenols from diazonium ions via the generation and oxidation of aryl radicals by copper salts”. The Journal of Organic Chemistry 42 (12): 2053–2058. doi:10.1021/jo00432a003. ISSN 0022-3263.
- ^ a b Galli, Carlo (August 1988). “Radical reactions of arenediazonium ions: An easy entry into the chemistry of the aryl radical”. Chemical Reviews 88 (5): 765–792. doi:10.1021/cr00087a004.
- ^ J. K. Kochi (1957). “The Mechanism of the Sandmeyer and Meerwein Reactions”. J. Am. Chem. Soc. 79 (11): 2942–2948. doi:10.1021/ja01568a066.
- ^ H. H. Hodgson (1947). “The Sandmeyer Reaction”. Chem. Rev. 40 (2): 251–277. doi:10.1021/cr60126a003.
- ^ Nonhebel, D. C.; Waters, W. A. (8 October 1957). “A Study of the Mechanism of the Sandmeyer Reaction”. Proceedings of the Royal Society A: Mathematical, Physical and Engineering Sciences 242 (1228): 16–27. Bibcode: 1957RSPSA.242...16N. doi:10.1098/rspa.1957.0150.
- ^ 1960-, Anslyn, Eric V. (2006). Modern physical organic chemistry. Dougherty, Dennis A., 1952-. Sausalito, CA: University Science. ISBN 978-1891389313. OCLC 55600610
- ^ C., Vollhardt, K. Peter (2018-01-29). Organic chemistry : structure and function. Schore, Neil Eric, 1948- (8e ed.). New York. ISBN 9781319079451. OCLC 1007924903
- ^ 1937-, Carey, Francis A. (2007). Advanced organic chemistry. Part B, Reactions and synthesis. Sundberg, Richard J., 1938- (5th ed.). New York, NY: Springer. ISBN 9781601195494. OCLC 223941000
- ^ Timms, Allan W.; Walton, Paul H.; Rowell, Simon C.; Hanson, Peter (2004-06-28). “Promotion of Sandmeyer hydroxylation (homolytic hydroxydediazoniation) and hydrodediazoniation by chelation of the copper catalyst: bidentate ligands” (英語). Organic & Biomolecular Chemistry 2 (13): 1838–1855. doi:10.1039/B404699D. ISSN 1477-0539. PMID 15227536.
- ^ Timms, Allan W.; Walton, Paul H.; Taylor, Alec B.; Rowell, Simon C.; Hanson, Peter (2002-05-22). “Sandmeyer reactions. Part 6. A mechanistic investigation into the reduction and ligand transfer steps of Sandmeyer cyanation” (英語). Journal of the Chemical Society, Perkin Transactions 2 0 (6): 1126–1134. doi:10.1039/B200747A. ISSN 1364-5471.
外部リンク
[編集]- Hiro (11 June 2009). "ザンドマイヤー反応 Sandmeyer Reaction". odos有機反応データベース. Chem-Station. 2024年6月8日閲覧。

