ゴーシュ型
ゴーシュ形(ゴーシュがた、英: gauche form)とは、立体配座の呼び方の一種であり、A−B−C−D と結合している4つの原子について、B−C結合の回転に由来したそれぞれの立体配座の中で、A−B結合とC−D結合の二面角が約60度の場合のものを指す。ゴーシュ配座とも呼ぶ。立体化学で用いられる用語である。gauche はフランス語の「ねじれた」という意味の語に由来している。
この語は1941年に 1,2-ジクロロエタンの立体配座に対して水島三一郎、森野米三らにより初めて使用された[1]。
この二面角が0度の時の立体配座は、シス (cis) 形、重なり形、シン (syn) 形あるいはエクリプス (eclipsed) 形とよばれ、180度の時は、トランス (trans) 形、あるいはアンチ (anti) 形とよばれる。
多くの鎖状化合物においては大きな置換基がアンチ形配座をとる立体配座がもっとも安定であり、次に安定なのがゴーシュ形配座である。一部の化合物においては立体電子効果によってゴーシュ配座がアンチ配座よりも安定になることがあり、これをゴーシュ効果という。
シクロヘキサン環のいす形配座においてはすべての C−C結合がゴーシュ形配座を取っており、環構造によってアンチ形配座は取りえないため、これが最安定配座となっている。
ゴーシュ効果
[編集]ゴーシュ効果とは、一部の化合物においてアンチ回転異性体よりもゴーシュ回転異性体が安定となる効果である[2]。この効果は1,2-ジフルオロエタン (H2FCCFH2) において存在し、気相では1,2-ジフルオロエタンのゴーシュ配座はアンチ配座よりも2.4〜3.4 kJ/mol安定である。1.2-ジメトキシエタンでも同様の効果が見られる。
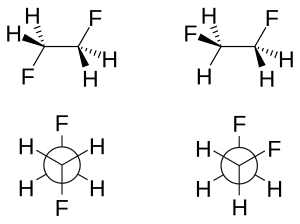

ゴーシュ効果には、主に超共役と曲がった結合の2種類の説明が存在する。超共役モデルでは、C–H σ結合性軌道からC–F σ*反結合性軌道への電子密度の供与がゴーシュ異性体における安定化の源であると考えられている。フッ素の大きな電気陰性度のため、C–H σ軌道はC–F σ軌道よりもよい電子供与体であり、一方でC–F σ*軌道はC–H σ*軌道よりもよい電子受容体である。ゴーシュ配座のみ、よりよい電子供与体とよりよい電子受容体との間の重なりが大きくなる。
ジフルオロエタンにおけるゴーシュ効果の曲がった結合による説明の鍵は、フッ素の大きな電気陰性度のために増加した2つのC-F結合のp軌道性である。この結果、中央のC-C結合の左右の上部と下部の電子密度が高くなる。軌道の重なりの減少は、ゴーシュ配座によって曲がった結合が形成される時に部分的に埋め合わせることができる。これら2つの内、ジフルオロエタンにおけるゴーシュ効果については超共役が主な原因であると一般的に考えられている[3][4]。
どちらの回転異性体の分子構造もin silico手法で補強された高分解能赤外分光法によって実験的に得ることができる[2]。上記のモデルによれば、炭素-炭素結合長はアンチ回転異性体の方が長い(151.4 pm vs. 150)。ゴーシュ回転異性体におけるフッ素原子間の立体反発によってCCF結合角(3.2° 増える)と、FCCF二面角(通常の60° から71° へ増える)が大きくなる。
類似の1,2-ジフルオロジフェニルエタンでは、スレオ異性体は2つのフェニル基と2つのフッ素基の間がアンチ配座を取ることが(X線散乱とNMRにおける結合定数から)明らかにされている。エリスロ異性体ではどちらの置換基もゴーシュ配座を取る[5]。In silicoの結果によれ、この配座は0.21 kcal/mol(0.88 kJ/mol)より安定である。
ゴーシュ効果は4連続synフッ素置換基を持つ分子でも報告されている[6]。
ゴーシュ効果は、2つの配座異性体の極性が大きく異なるため、溶媒効果に対して非常に敏感である。例えば、個体状態においてゴーシュ配座のみで存在する2,3-ジニトロ-2,3-ジメチルブタンは、ベンゼン溶液中では79:21の比でゴーシュ配座が優先するが、四塩化炭素中では58:42でアンチ配座が優先する[7]。trans-1,2-ジフルオロシクロヘキサンの場合、より極性の高い溶媒中ではeq/eq配座の比率がより大きくなる[4]。
類似した効果にアルケンにおけるシス効果がある。
脚注
[編集]- ^ Yonezo Morino (1985). “Discovery of the gauche form in dichloroethane”. Journal of Molecular Structure 126: 1-8. doi:10.1016/0022-2860(85)80100-9.
- ^ a b Norman C. Craig, Anthony Chen, Ki Hwan Suh, Stefan Klee, Georg C. Mellau, Brenda P. Winnewisser, and Manfred Winnewisser (1997). “Contribution to the Study of the Gauche Effect. The Complete Structure of the Anti Rotamer of 1,2-Difluoroethane”. J. Am. Chem. Soc. 119 (20): 4789 - 4790. doi:10.1021/ja963819e.
- ^ Goodman, L.; Gu, H.; Pophristic, V. (2005). “Gauche Effect in 1,2-Difluoroethane. Hyperconjugation, Bent Bonds, Steric Repulsion”. J. Phys. Chem. A. 109: 1223-1229. doi:10.1021/jp046290d.
- ^ a b David O'Hagan (2008). “Understanding organofluorine chemistry. An introduction to the C–F bond”. Chem. Soc. Rev. 37: 308-319. doi:10.1039/b711844a.
- ^ O'Hagan D, Rzepa H, Schuler M, Slawin A (2006). “The vicinal difluoro motif: The synthesis and conformation of erythro- and threo- diastereoisomers of 1,2-difluorodiphenylethanes, 2,3-difluorosuccinic acids and their derivatives”. Beilstein Journal of Organic Chemistry 2: 19. doi:10.1186/1860-5397-2-19.
- ^ Luke Hunter, David O'Hagan, and Alexandra M. Z. Slawin (2006). “Enantioselective Synthesis of an All-syn Four Vicinal Fluorine Motif”. J. Am. Chem. Soc. 128 (51): 16422 - 16423. doi:10.1021/ja066188p.
- ^ Smith, Michael. B.; March, J. (2001). March's Advanced Organic Chemistry (5th edition ed.). Wiley. ISBN 0-471-58589-0
