オキシ-コープ転位
| Oxy-Cope rearrangement | |
|---|---|
| 名の由来 | アーサー・C・コープ |
| 種類 | 転位反応 |
| 識別情報 | |
| Organic Chemistry Portal | cope-rearrangement |
| RSC ontology ID | RXNO:0000029 |
有機化学において、オキシ-コープ転位(オキシ-コープてんい、英: Oxy-Cope rearrangement)は、化学反応の1つである。反応には特定の不飽和アルコールの骨格の再構成が含まれる。コープ転位のバリエーションであり、1,5-ジエン-3-オールが [3,3]-シグマトロピー転位に典型的な機構によって不飽和カルボニル化合物へと変換される[1][2]。
本反応は高い一般性を持つ。多様な前駆体が予想通りにそして容易にこの転位反応を起こす。そのためオキシ-コープ転位は極めて有用な合成ツールとなっている[3]。さらに、必要となる出発材料の生産は簡単であることが多い。本反応は1964年にBeronとJonesによって提唱され、命名された。反応の駆動力は自発的ケト-エノール互変異性化によるカルボニルの形成である[4]。
塩基は反応を1010–1017加速する(アニオン性オキシ-コープ転位)[5]。
エノラートの形成によってほとんどの場合反応は不可逆となる[3][4][6]。
歴史
[編集]シグマトロピー転位は有機合成において有用である[6]。1,5-ジエンのC-3位にアルコールを持つ基質が反応に耐えることを証明することでコープ転位の多用途性を示そうとする中で、BersonとJonesは二環性ジエンアルコールを気相で加熱することで、かなりの収率でcis-∆5,6-octaloneを得た[1]。
この改良法は、それ以前に利用できなかった様々な合成操作によく適した2つの共通点のない新たな官能基が得られるため非常に魅力的である。
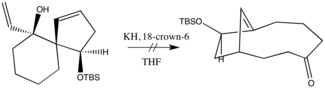
1975年にエヴァンズとGolobが塩基によるとてつもない反応速度増大を報告し、次の進歩が起こった。水素化カリウムとクラウンエーテルを組み合わせた彼らの合成法はほとんどの応用における標準の手法となった。実際は、一部の場合、過度に反応性のあるエノラート生成物の産生へ対応するため、アニオン補助は意図的に控えられる。例えば、タールのみが得られた以下の反応において、著者らはこの結果を生成物の塩基に対する見せ掛けの不耐性が原因としている[7]。したがって、元々のオキシ-コープ改良法は今日に至るまで合成化学において現実の問題に直結するニッチを占めている。
機構
[編集]オキシ-コープ転位の中性およびアニオン性変法はどちらも協奏反応機構あるいは段階的ラジカル経路を経て進行するが、前者の様式が一般的に好まれる[8][9]。望ましい中間体はいす形様配座を特徴とする[10]。キラリティー転写は高秩序の遷移状態によって影響される[4][10]。最も容易に到達できる遷移状態中の二重結合の位置が本反応の立体化学的進行を決定する[3]。舟形遷移状態は不利であるが、相当程度この経路を経て転位が通常起こるため、ジアステレオ混合物が生成する。
にもかかわらず、いす形配座が幾何的に不可能な転位は起こる。実際、エノラート形成は脱芳香族化と舟形配座の両方と関連したエネルギー障壁を乗り越えるために十分な駆動力を供給する[12]。
上に示されている協奏的、同期的経路が一般に支配的である。アニオン性オキシ-コープ転位過程では、ヘテロ開裂がホモ開裂よりも17–34 kcal/mol有利であると計算された[13]。いくつかの要素がこのエネルギーギャップを橋渡ししうる[10]。
大きなひずみとメチル基の体積の存在によって、期待される (E)-シクロオクテノン異性体の代わりに (Z)-異性体が有利となった。この結果は、中間体が同期的に形成されていないことを示唆する。断片化とそれに続く異性化のみが観測された生成物を合理的に説明することができる[10]。
完全に気相で行われたアニオン性オキシ-コープ転位の研究は、反応速度増大が溶媒相互作用に由来するものではなく、構造それ自身に由来すると報告した[14]。
反応速度増大
[編集]一般に、オキシ-コープまたはアニオン性オキシ-コープ基質の安定性の生成物の安定性と比較した低下は、基底状態不安定化の原理によって反応速度の増大をもたらす。アニオン性オキシ-コープ転位では電子豊富なオキシアニオンから切断するσ結合の反結合性σ* 軌道へのn供与によって、このσ結合が弱まり(基底状態が不安定化し)、反応が加速される、と説明される[3]。
金属とアルコキシドとの間のイオン性相互作用は重要である。これらの解離特性によって反応速度の加速が引き起こされる[5]。15-クラウン-5を水素化ナトリウムと合わせて使用すると二環性ジエンアルコキシドのエノラート生成物へのシグマトロピー変換の進行において1.27倍の反応速度増大がもたらされたが、15-クラウン-5の代わりにHMPAを使った同じ反応では目に見えた反応速度への影響はなかった。18-クラウン-6と併わせて水素化カリウムを使用すると最大180倍の反応速度の加速がもたらされる。上記の結果から、反応速度はカウンターイオンが点電荷を近似しにくい程、そしてカウンターイオン補足種の添加によって加速される、と結論付けられた。
より極性の高い溶媒や触媒量の相間移動塩を含めることも、同じく速度増大効果を示すことが実証されている[15]。
最後に、転位の進行の間の環ひずみの解消はより強制的に完了まで反応を駆動し、したがって反応速度を増大するだろう。
適用範囲
[編集]天然物には8員環を含むクラスが複数存在し、それらの合成は困難なことが分かっているため、アニオン性オキシ-コープ転位は適せひた代替経路として脚光を浴びてきた。天然物合成におけるその応用では素晴しい立体化学制御が可能であり、その利用はこの合成法の開発以前に利用されていた比較的うまくいかなかった経路よりもはるかに一般的である[16]。
見込まれる幾何的制限にもかかわらず、必要となる不飽和基質はいずれの二重結合の代わりとしても三重結合を含むことができる。こういったアルキノールはポイテジオールとダクチロールの見事な合成において効果的に用いられた[6]。これらの興味深いシグマトロピー転位はアニオン補助あるいは熱的条件下のいずれでも起こり得る[17]。
特に興味深いのは、中間生成物が予測可能な形でさらに反応して望みの最終生成物を供給する状況へのオキシ-コープ転位の応用である。この目標は下のcis-ヒドロアズレノンの合成において達成された。ここでオキシ-コープ中間体は遠隔SN置換を起こしやすい立体電子的配置が特徴である[18]。
追加検討事項
[編集]アニオン性オキシ-コープ転位のために頻繁に利用される試薬である水素化カリウムは、ジエノラート中間体を破壊することが示唆されている微量の不純物を時折混入しており、そのため重合が起こってしまう。Mcdonaldらは、購入した水素化カリウムのバッチ内に残存しているかもしれない超酸化カリウムを除去するためにヨウ素による前処理を指示した。この単純な準備段階は、Mcdonaldらの論文で説明されている通り、収率と結果の再現性の両方において劇的な改善効果をもたらす[19]。
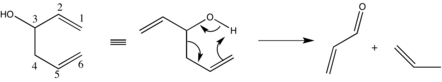
重要な副反応にヘテロシス開裂がある。ここでは、ホモアリルアルコールがカルボニルとアリル系へ分解する[20]。
この現象の抑制は、金属-アルコキシド結合のイオン性を減少させることによって容易に達成可能である。具体的には、より電気的に陰性なアルカリ金属またはカチオンの溶媒和に適さない溶媒を使用することが望ましい効果を生む[21]。
出典
[編集]- ^ a b Berson, Jerome A.; Jones, Maitland (1964). “A Synthesis of Ketones by the Thermal Isomerization of 3-Hydroxy-1,5-hexadienes. The Oxy-Cope Rearrangement”. J. Am. Chem. Soc. 86 (22): 5019–5020. doi:10.1021/ja01076a067.
- ^ Cope, Arthur C.; Hardy, Elizabeth M. (1940). “The Introduction of Substituted Vinyl Groups. V. A Rearrangement Involving the Migration of an Allyl Group in a Three-Carbon System”. J. Am. Chem. Soc. 62 (2): 441–444. doi:10.1021/ja01859a055.
- ^ a b c d Paquette, Leo A. (1997). “Recent Applications of Anionic Oxy-Cope Rearrangements”. Tetrahedron 53 (41): 13971–14020. doi:10.1016/S0040-4020(97)00679-0.
- ^ a b c Kürti, Lázló; Czakó, Barbara (2005). Strategic Applications of Named Reactions in Organic Synthesis. Burlington: Elsevier Inc.. p. 325
- ^ a b Evans, D. A.; Golob, A. M. (1975). “[3,3]Sigmatropic Rearrangements of 1,5-Diene Alkoxides. The Powerful Accelerating Effects of the Alkoxide Substituent”. J. Am. Chem. Soc. 97 (16): 4765–4766. doi:10.1021/ja00849a054.
- ^ a b c Wilson, Stephen R. (1993). “Anion-Assisted Sigmatropic Rearrangements”. Org. React. 43 (2): 93–250. doi:10.1002/0471264180.or043.02.
- ^ Paquette, Leo A.; Ladouceur, Gaetan (1989). “Synthetic Studies Targeted at the Cytotoxic 8,9-Seco-ent-kaurene Diterpenes. Concise Complementary Stereocontrolled Construction of the Bridgehead Olefin Core”. J. Org. Chem. 54 (18): 4278–4279. doi:10.1021/jo00279a010.
- ^ Evans, D. A.; D. J., Baillargeon (1978). “Alkoxide Substituent Effects on Carbon—Carbon Bond Homolysis”. Tetrahedron Letters 19 (36): 3319–3322. doi:10.1016/S0040-4039(01)85627-6.
- ^ Paquette, Leo A.; Pierre, Francis; Cottrell, Charles E. (1987). “Anionic Rearrangements of syn- and anti-7-Cyclopentenyl-7-hydroxynorbornenes. The Case for Sequential Ring Cleavage and Intramolecular Michael Addition”. J. Am. Chem. Soc. 109 (19): 5731–5740. doi:10.1021/ja00253a027.
- ^ a b c d Maurin, Philippe; Kim, Se-Ho; Cho, Sung Yun; Cha, Jin Kun (2003). “On the Mechanism of the Anionic Oxy-Cope Rearrangement of trans-1,2-Dialkenylcyclobutanols”. Angew. Chem. 42 (41): 5044–5047. doi:10.1002/anie.200350988.
- ^ Evans, D. A.; Nelson, John V. (1980). “Stereochemical Study of the [3,3] Sigmatropic Rearrangement of 1,5-Diene-3-alkoxides. Application to the Stereoselective Synthesis of (±)-Juvabione”. J. Am. Chem. Soc. 102 (2): 774–782. doi:10.1021/ja00522a056.
- ^ Ogawa, Yasushi; Ueno, Tetsuya; Karikomi, Michinori; Seki, Katsura; Haga, Kazuo; Uyehara, Tadao (2001). “Synthesis of 2-Acetoxy[5]helicene by Sequential Double Aromatic Oxy-Cope Rearrangement”. Tetrahedron Lett. 43: 7827–7829. doi:10.1016/s0040-4039(02)01611-8.
- ^ Evans, D.A.; Baillargeon, D.J. (1978). “Intrinsic Fragmentation Modes of Primary Alkoxides”. Tetrahedron Lett. 19 (36): 3315–3318. doi:10.1016/S0040-4039(01)85626-4.
- ^ Baldwin, John E.; Black, Kersey A. (1984). “Complete Kinetic Analysis of Thermal Stereomutations among the Eight 2,3-Dideuterio-2-(methoxymethyl)spiro[cyclopropane-1,1'-indenes]”. J. Am. Chem. Soc. 106 (4): 1029–1040. doi:10.1021/ja00316a036.
- ^ Georges, Michael; Tam, Tim F.; Fraser-Reid, Bert (1985). “Controlled Access to Furanose Precursors Related to Sesquiterpene Lactones. 1”. J. Org. Chem. 50 (26): 5747–5753. doi:10.1021/jo00350a062.
- ^ Gadwood, Robert C.; Lett, Renee M. (1982). “Preparation and Rearrangement of 1,2-Dialkenylcyclobutanols. A Useful Method for Synthesis of Substituted Cyclooctenones”. J. Org. Chem. 47 (12): 2268–2275. doi:10.1021/jo00133a007.
- ^ Viola, Alfred; MacMillan, John H. (1970). “Vapor Phase Acetylenic Oxy-Cope Reaction of 5-Hexen-1-yn-3-ol. The Chemistry of an Allenol Intermediate”. J. Am. Chem. Soc. 92 (8): 2404–2410. doi:10.1021/ja00711a034.
- ^ Sworin, Michael; Lin, Ko Chung (1987). “Cyclopentanoid Synthesis via the Intramolecular Trapping of Oxy-Cope Intermediates. Stereocontrolled Synthesis of the cis- and trans-Hydroazulene Skeleton”. J. Org. Chem. 52 (25): 5640–5642. doi:10.1021/jo00234a029.
- ^ Macdonald, Timothy L.; Natalie, Kenneth J.; Prasad, Girija; Sawyer, J. Scott (1986). “Chemically Modified Potassium Hydride. Significant Improvement in Yields in Some Oxy-Cope Rearrangements”. J. Org. Chem. 51 (7): 1124–1126. doi:10.1021/jo00357a035.
- ^ Snowden, Roger L.; Muller, Bernard L.; Schulte-Elte, Karl H. (1981). “Fragmentation of Homoallylic Alkoxides. Synthesis of Propenyl and 2-Methylpropenyl Ketones from Carboxylic Esters”. Tetrahedron Lett. 23 (3): 335–338. doi:10.1016/S0040-4039(00)86824-0.
- ^ Evans, D. A.; Baillargeon, David J.; Nelson, John V. (1978). “A General Approach to the Synthesis of 1,6-Dicarbonyl Substrates. New Applications of Base-Accelerated Oxy-Cope Rearrangements”. J. Am. Chem. Soc. 100 (7): 2242–2244. doi:10.1021/ja00475a051.