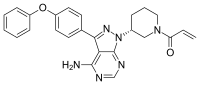
イブルチニブ
 | |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| 販売名 | Imbruvica |
| ライセンス | US FDA:リンク |
| 胎児危険度分類 |
|
| 法的規制 |
|
| 薬物動態データ | |
| 血漿タンパク結合 | 97.3% |
| 代謝 | Hepatic (CYP3A & CYP2D6) |
| 半減期 | 4–6 時間 |
| 排泄 | 糞中 (80%), 尿中 (10%) |
| 識別 | |
| CAS番号 | 936563-96-1 |
| ATCコード | L01XE27 (WHO) |
| PubChem | CID: 24821094 |
| IUPHAR/BPS | 6912 |
| ChemSpider | 26637187 |
| UNII | 1X70OSD4VX |
| KEGG | D10223 |
| ChEBI | CHEBI:76612 |
| ChEMBL | CHEMBL1873475 |
| 化学的データ | |
| 化学式 | C25H24N6O2 |
| 分子量 | 440.4971 |
| |
| |
イブルチニブ(Ibrutinib)は、B細胞性腫瘍の治療に用いられる抗がん剤である。経口投与可能な選択的不可逆的酵素阻害薬であり、ブルトン型チロシンキナーゼ(Bruton's tyrosine kinase; BTK)を阻害する[1][2]。 商品名イムブルビカ。開発コードPCI-32765(ヤンセンファーマ製造販売)。
リンパ球の一つであるB細胞に由来する悪性腫瘍である瀰漫性大細胞型B細胞性リンパ腫や多発性骨髄腫[3][4]の治療に使用される。
米国では2013年11月にマントル細胞リンパ腫[5][6]への使用が、2014年2月に慢性リンパ性白血病[7]への使用が承認された。2015年1月には、非ホジキンリンパ腫の一種であるワルデンシュトレーム型マクログロブリン血症への使用が可能となった[8]。
日本では2016年3月に「再発または難治性の慢性リンパ性白血病(小リンパ球性リンパ腫を含む)」について承認された[9]。2016年6月現在では、「再発または難治性のマントル細胞リンパ腫」に対して追加承認申請されている[10]。
効能・効果
[編集]- 日本
- 再発または難治性の慢性リンパ性白血病(小リンパ球性リンパ腫を含む)[11]、再発または難治性のマントル細胞リンパ腫
- 造血幹細胞移植後の慢性移植片対宿主病(ステロイド剤の投与で効果不十分な場合)
- 米国
- マントル細胞リンパ腫、慢性リンパ性白血病[7]、ワルデンシュトレーム型マクログロブリン血症
- アメリカ食品医薬品局(FDA)は2017年8月2日、成人の造血幹細胞移植後の慢性移植片対宿主病(GVHD)で従来の治療での不成功例に対してのイブルチニブの適応拡大を承認した。
- 欧州
- 慢性リンパ性白血病、マントル細胞リンパ腫、ワルデンシュトレーム型マクログロブリン血症[12]
禁忌
[編集]次の患者には禁忌とされている。
- 中等度以上の肝機能障害のある患者
副作用
[編集]治験時の副作用発生率は国内治験で100%、海外治験で90.8%であった[11]。
日本の添付文書で重大な副作用とされているものは、
- 出血(脳出血、消化管出血など)、白血球症(頭蓋内出血、嗜眠、不安定歩行、頭痛などを伴う)、
- 重篤な感染症(肺炎(11.8%)、敗血症(2.1%)など)、
- 進行性多巣性白質脳症(PML)(意識障害、認知障害、麻痺症状(片麻痺、四肢麻痺)、言語障害などを伴う)、
- 重篤な骨髄抑制(貧血(10.3%)、好中球減少症(15.9%)、血小板減少症(9.2%)など)、
- 重篤な不整脈(心房細動(2.6%)、心房粗動(1.0%)など)、
- 腫瘍崩壊症候群(時に遅発性)、
- 重篤な過敏症(アナフィラキシーなど)、
- 皮膚粘膜眼症候群(Stevens-Johnson症候群)、
- 肝不全、肝機能障害(ALT(GPT)、AST(GOT)、ビリルビンなどの上昇)、
- 間質性肺疾患
である(頻度未記載は頻度不明)。
米国の添付文書で頻度別に記載されている副作用は[6][13][11]、
・10%超に発生する副作用(太字は国内治験で40%以上)
- 血清クレアチニン上昇
- 血小板減少症
- 出血
- 点状出血
- 鼻出血
- 好中球減少症
- 貧血
- 疲労
- 筋骨格系の痛み
- 末梢浮腫
- 痣
- 発疹
- 呼吸困難
- 便秘
- 下痢
- 腹痛
- 嘔気
- 嘔吐
- 食欲低下
- 消化不良
- 発熱
- 口内炎
- 咳
- 副鼻腔炎
- 上気道感染
- 肺炎
- 皮膚感染症
- 尿路感染
- 脱力感
- 筋肉の痙攣
- 眩暈
- 頭痛
- 脱水
- 関節痛
- 血中ビリルビン増加
・1%から10%に発生する副作用
- 大出血(グレード3/4)
- 二次発癌
である。
臨床試験
[編集]マントル細胞リンパ腫
[編集]対照群のない臨床試験で1剤以上の前治療歴(中央値:3)のあるマントル細胞リンパ腫の患者111名にイブルチニブが投与された。11%の患者は骨髄移植を経験していた。投与開始前は39%の患者で直径5cm以上の腫瘍が1つ以上存在していた。これら進行がん患者での奏効率(ORR)は66%で完全奏効率は17%であった。奏効期間中央値は17.5ヶ月であった[14]。
作用機序
[編集]イブルチニブは慢性リンパ性白血病(CLL)細胞のケモカイン(CXCL12およびCXCL13)に対する走化性を減少させ、B細胞受容体(BCR)への刺激に基づく細胞接着を阻害する[15][16]。これらの結果はまたイブルチニブがどの様にBCRを阻害して細胞をアポトーシスに導き、または細胞の遊走と接着による腫瘍周囲の微細環境維持を妨げるかを知る手掛かりとなる。
CLL細胞を用いた前臨床研究では、イブルチニブは細胞のアポトーシスを促進し、増殖を阻害し、腫瘍環境から分泌される細胞生存因子からCLL細胞を隔離することが明らかにされた[17]。増殖中のCLL細胞をイブルチニブで処理すると、ブルトン型チロシンキナーゼ(BTK)のリン酸化が阻害され、BTKで活性化されるERK1/2、PI3K、NF-κB等の生存経路(シグナル量)が低減する。加えて、イブルチニブはin vitro でCLL細胞の増殖を阻害し、他のCLL細胞からの可溶性因子(CD40L、BAFF、IL-6、IL-4、TNF-α)を含む生存シグナルやフィブロネクチンによる細胞接着、間質細胞との接触を妨げる。
早期臨床研究では、イブルチニブは一過性のリンパ球増加を伴いリンパ節腫脹を急速に縮小させるとされ、これはイブルチニブが細胞塊形成または遊走に関する腫瘍微細環境を直接妨げている可能性を示唆していた[18]。
開発の経緯
[編集]イブルチニブの最初の合成は2007年に報告された。BTKのATP結合部位に近い481位のシステインに共有結合してBTKを不活性化させる様に構造手法を用いて設計された[1]。イブルチニブは481位システイン残基にマイケル付加し、不可逆的に結合してBTKを失活させる。2006年4月、BTK阻害薬探索プログラムの一環としてPCI-32765が取り上げられ、in vivo での抗リンパ腫活性が確認され、前臨床研究が始められた[19]。関節炎への有効性も示唆されている[20]。米国食品医薬品局は2013年11月にマントル細胞リンパ腫の治療薬としてイブルチニブを承認した後[5]、2014年2月には慢性リンパ性白血病(CLL)について[21]、2014年7月には染色体17p欠失CLLについて追加承認した。2015年1月にはさらに、ワルデンシュトレーム型マクログロブリン血症への使用が承認された[8]。
日本では2014年に慢性リンパ性白血病、小リンパ球性リンパ腫、マントル細胞リンパ腫の治療薬として希少疾病用医薬品に指定され[22]、同年11月に承認申請され[23]、2016年3月に慢性リンパ性白血病(小リンパ球性リンパ腫を含む)について承認された[9]。マントル細胞リンパ腫については2016年3月に承認申請された[10]。
関連項目
[編集]出典
[編集]- ^ a b “Discovery of selective irreversible inhibitors for Bruton's tyrosine kinase”. ChemMedChem 2 (1): 58–61. (Jan 2007). doi:10.1002/cmdc.200600221. PMID 17154430.
- ^ US patent 7514444, Honigberg L, Verner E, Pan Z, "Inhibitors of Bruton's Tyrosine Kinase", published 7 April 2009, issued 28 December 2006, assigned to Pharmacyclics Inc
- ^ “Collaborative Development and Worldwide License Agreement for Investigational Anti-Cancer Drug, PCI-32765”. PRNewswire-FirstCall. Janssen Biotech, Inc (8 December 2011). 2016年6月15日閲覧。
- ^ “Clinical trials involve ibrutinib”. ClinicalTrials.gov. 2016年6月15日閲覧。
- ^ a b “FDA approves Imbruvica for rare blood cancer”. United States Food and Drug Administration. 2016年6月15日閲覧。
- ^ a b “Imbruvica (Ibrutinib)”. Medscape Reference. WebMD. 13 January 2014閲覧。
- ^ a b Azvolinsky, PhD, Anna. “FDA Approves Ibrutinib for Chronic Lymphocytic Leukemia”. Cancer Network. 14 February 2014閲覧。
- ^ a b “FDA Expands Approved Use of Imbruvica for Waldenström’s Macroglobulinemia”. Drugs.com (January 29, 2015). 2016年6月15日閲覧。
- ^ a b “再発・難治性の慢性リンパ性白血病治療剤「イムブルビカカプセル140mg」製造販売承認を取得”. ヤンセンファーマ. 2016年6月15日閲覧。
- ^ a b “抗悪性腫瘍剤「イムブルビカカプセル140mg」 再発又は難治性マントル細胞リンパ腫へ適応追加申請”. ヤンセンファーマ. 2016年6月15日閲覧。
- ^ a b c “イムブルビカカプセル140mg 添付文書” (2016年5月). 2016年7月4日閲覧。
- ^ “EMA Imbruvica About”. European Medicines Agency. 2016年6月15日閲覧。
- ^ “IMBRUVICA (ibrutinib) capsule [Pharmacyclics, Inc]”. DailyMed. Pharmacyclics, Inc (November 2013). 13 January 2013閲覧。
- ^ “Highlights of Imbruvica Prescribing Information” (PDF). United States Food and Drug Administration. 2016年6月15日閲覧。
- ^ “The Bruton tyrosine kinase inhibitor PCI-32765 thwarts chronic lymphocytic leukemia cell survival and tissue homing in vitro and in vivo”. Blood 119 (5): 1182–1189. (Feb 2012). doi:10.1182/blood-2011-10-386417. PMID 22180443.
- ^ “The clinically active BTK inhibitor PCI-32765 targets B-cell receptor- and chemokine-controlled adhesion and migration in chronic lymphocytic leukemia”. Blood 119 (11): 2590–2594. (Mar 2012). doi:10.1182/blood-2011-11-390989. PMID 22279054.
- ^ “B-cell receptor signalling and its crosstalk with other pathways in normal and malignant cells”. European Journal of Haematology 94 (3): n/a. (Mar 2015). doi:10.1111/ejh.12427. PMID 25080849.
- ^ “Ibrutinib (PCI-32765), the first BTK (Bruton's tyrosine kinase) inhibitor in clinical trials”. Curr Hematol Malig Rep 8 (1): 1–6. (2013). doi:10.1007/s11899-012-0147-9. PMC 3584329. PMID 23296407.
- ^ “The Bruton tyrosine kinase inhibitor PCI-32765 blocks B-cell activation and is efficacious in models of autoimmune disease and B-cell malignancy”. Proceedings of the National Academy of Sciences of the United States of America 107 (29): 13075–80. (Jul 2010). doi:10.1073/pnas.1004594107. PMC 2919935. PMID 20615965.
- ^ “The Bruton tyrosine kinase inhibitor PCI-32765 ameliorates autoimmune arthritis by inhibition of multiple effector cells”. Arthritis Research & Therapy 13 (4): R115. (2011). doi:10.1186/ar3400. PMC 3239353. PMID 21752263.
- ^ “Ohio State Cancer Research Played a Significant Role in FDA Approval of Important New CLL Drug”. The Ohio State University (14 February 2014). 2016年6月15日閲覧。
- ^ “希少疾病用医薬品の指定について” (PDF) (2014年6月11日). 2016年6月15日閲覧。
- ^ “抗悪性腫瘍剤イブルチニブ日本における製造販売承認申請のお知らせ” (2014年11月26日). 2016年6月15日閲覧。
