ルビプロストン
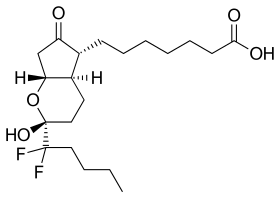 | |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| 販売名 | Amitiza |
| Drugs.com | monograph |
| MedlinePlus | a607034 |
| ライセンス | US FDA:リンク |
| 胎児危険度分類 |
|
| 法的規制 |
|
| 薬物動態データ | |
| 生物学的利用能 | Negligible |
| 血漿タンパク結合 | 94% |
| 代謝 | Extensive, CYP not involved |
| 半減期 | Unknown (lubiprostone) 0.9–1.4 hours (main metabolite) |
| 排泄 | Renal (60%) and fecal (30%) |
| データベースID | |
| CAS番号 |
136790-76-6 |
| ATCコード | A06AX03 (WHO) |
| PubChem | CID: 157920 |
| DrugBank |
DB01046 |
| ChemSpider |
138948 |
| UNII |
7662KG2R6K |
| KEGG |
D04790 |
| ChEMBL |
CHEMBL1201134 |
| 別名 |
Amitiza RU-0211 SPI-0211 |
| 化学的データ | |
| 化学式 | C20H32F2O5 |
| 分子量 | 390.462 g/mol |
| |
ルビプロストン(Lubiprostone)は、主に過敏性腸症候群に関連する慢性特発性便秘症やオピオイド投与の副作用としての便秘の治療に用いられる医薬品である。米国で2006年1月[1]に(2007年9月、2013年4月に承認追加)、日本では2012年7月[2]に承認された。商品名アミティーザ。
効能・効果
[編集]ルビプロストンは原因不明の成人の慢性便秘の治療に用いられる[3]。日本での効能・効果は「慢性便秘症(器質的疾患による便秘を除く)」である[4]。
またルビプロストンは非癌性疼痛の治療にオピオイドを用いた場合の副作用として発現する便秘の治療に用いられる。しかし、ジフェニルヘプタン系オピオイド(メサドンなど)を服用している患者に対しての安全性は確立していない。
より少量で、18歳以上の女性の過敏性腸症候群患者の便秘治療に用いられる[3]。
2014年11月時点では、小児の患者については臨床試験は実施されていない。術後の腸機能不全についての適応が研究されている。
副作用
[編集]臨床試験での副作用は62.2%に見られ、最も多かった副作用は下痢(30.2%)であり(下痢は処方されて1日目服用で症状が出たケースがありました)、5%以上発現した副作用は他に嘔気(23.2%)、頭痛(5.7%)、胸部不快感(5.4%)であった[5]:28。
禁忌
[編集]腫瘍,ヘルニアなどによる腸閉塞が確認されているまたは疑われる患者には禁忌とされている[4]。肝・腎合併症を有する患者への使用経験はない。妊婦または妊娠している可能性のある婦人には禁忌であり、モルモットによる実験で胎児喪失が認められている[4]。ラットで乳汁中への移行が報告されている。慢性の下痢、腸閉塞、慢性下痢型過敏性腸症候群の患者には用いてはならない。
作用機序
[編集]ルビプロストンは2つの環状構造を有する脂肪酸誘導体であり、消化管上皮細胞の先端に発現しているClC塩素チャネル-2を特異的に活性化するプロスタグランジンE1を基に開発された。ClC塩素チャネル-2からは塩化物を多く含む液体が分泌され、便を軟化させ、消化管の運動性を高め、自発的排便を促進する。
腹痛や鼓腸といった便秘の諸症状は通常1週間以内に改善する。自発的腸運動は服用後1日以内に発生する。
薬物動態学
[編集]ルビプロストンは他の瀉下薬の様な耐性、依存性、血中電解質異常を示さない。治療中止に伴うリバウンドを起こさないが、中止後徐々に治療前の状態に戻っていくと思われる。
ルビプロストンは服用後直ぐに消化管に分布し作用を発現する。ルビプロストンはカルボニル還元酵素で急速に酸化・還元(15位の還元,α鎖のβ酸化,ω鎖のω酸化[4])され消失する。これは肝臓のシトクロムP450によるものではない。主要代謝産物M3の血中濃度は非常に低く、総投与量の10%未満である。これは代謝が胃および空腸で局所的に起こることを示している。
中等度ならびに重度肝機能障害患者ではM3のCmaxおよびAUCtは健康成人と比べてそれぞれ66%および119%、183%および521%高かった。また重度の腎機能障害のある患者では健康成人と比べて25%および12%高かった[4]。
化学合成
[編集]以下のようなルビプロストンの合成経路が報告されている[6]。

承認
[編集]2014年時点で、米国、日本、スイス、英国で承認されており、カナダで審議中である[7]。
参考文献
[編集]出典
[編集]- ^ “Amitiza Approval History”. 2015年1月15日閲覧。
- ^ “スキャンポ社、アボット社、日本におけるアミティーザの製造販売承認を発表”. アボット ジャパン株式会社、スキャンポファーマシューティカルズ・インク (2012年7月6日). 2015年1月15日閲覧。
- ^ a b “amitiza”. The American Society of Health-System Pharmacists. 3 April 2011閲覧。
- ^ a b c d e “アミティーザカプセル24µg 添付文書” (2016年9月). 2016年11月6日閲覧。
- ^ “アミティーザカプセル24μg インタビューフォーム” (PDF) (2015年11月). 2016年7月3日閲覧。
- ^ Sobrera, L. A.; Castaner, J. (2004). Drugs of the Future 29 (4): 336.
- ^ House, Douglas W. (31 December 2014). “Canada accepts Sucampo's NDS for constipation med”. Seeking Alpha
参考文献
[編集]- Katzung, B.G. (2007). Basic and Clinical Pharmacology, 10th edition. McGraw-Hill
