ヘキサクロロ白金(IV)酸ナトリウム
この項目「ヘキサクロロ白金(IV)酸ナトリウム」は翻訳されたばかりのものです。不自然あるいは曖昧な表現などが含まれる可能性があり、このままでは読みづらいかもしれません。(原文:en: Sodium hexachloroplatinate) 修正、加筆に協力し、現在の表現をより自然な表現にして下さる方を求めています。ノートページや履歴も参照してください。(2024年12月) |
| ヘキサクロロ白金(IV)酸ナトリウム | |
|---|---|
| |

| |
別称 クロロ白金酸ナトリウム 六塩化白金酸二ナトリウム 塩化第二白金酸ナトリウム錯塩 | |
| 識別情報 | |
| CAS登録番号 | 16923-58-3 |
| PubChem | 11134193 |
| ChemSpider | 9309311 |
| UNII | Q7589P090H |
| EC番号 | 240-983-5 |
| |
| |
| 特性 | |
| 化学式 | Na 2PtCl 6 |
| モル質量 | 453.7742 g/mol(無水物) 561.86588 g/mol(6水和物) |
| 外観 | 橙色結晶 |
| 密度 | 2.5 g/cm3 |
| 水への溶解度 | 可溶 |
| 危険性 | |
| GHSピクトグラム |   
|
| GHSシグナルワード | 警告(WARNING) |
| Hフレーズ | H300, H301, H317, H318, H334 |
| Pフレーズ | P261, P264, P270, P272, P280, P285, P301+310, P302+352, P304+341, P305+351+338, P310, P321, P330, P333+313 |
| 関連する物質 | |
| その他の陰イオン | ヘキサフルオロリン酸ナトリウム ヘキサフルオロアルミン酸ナトリウム |
| その他の陽イオン | ヘキサクロリド白金(IV)酸カリウム ヘキサクロリド白金(IV)酸アンモニウム |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
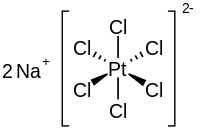
ヘキサクロロ白金(IV)酸ナトリウム(ヘキサクロロはっきんよんさんナトリウム、英: Sodium hexachloroplatinate(IV), 独: Natriumhexachloroplatinat(IV))はヘキサクロロ白金(IV)酸のナトリウム塩である。組成式Na
2[PtCl
6]であらわされる無機化合物であり、ナトリウムカチオンとヘキサクロロ白金(IV)酸アニオンからなる。無水ヘキサクロロ白金(IV)酸ナトリウムは黄色を呈するが、湿った空気中ではオレンジ色の6水和物を生じる。6水和物は110 °Cで熱することにより脱水できる[1]。
最も使用量の多い用途は195Pt-NMR分光法における化学シフト基準物質である。すなわち、溶液に含まれるその他の白金化学種の化学シフトはヘキサクロロ白金(IV)酸ナトリウムの化学シフトからの比率で報告される[2]。
調製と反応
[編集]ヘキサクロロ白金(IV)酸ナトリウムは、王水に白金を溶かして得られたヘキサクロロ白金(IV)酸を塩化ナトリウムと反応させて乾かすことにより乾燥した塩として得られ、さまざまな白金錯体の調製における中間体として用いられる[3]。。
- Pt + 4 HNO
3 + 6 HCl → H
2[PtCl
6] + 4 NO
2 + 4 H
2O - H
2[PtCl
6] + 2 NaCl → Na
2[PtCl
6] + 2 HCl
この塩はアンモニウム塩へ転換したのちに熱分解させることにより金属白金として回収することができ、実験廃液からはこの方法で回収される。
- Na
2[PtCl
6] + 2 NH
4Cl → (NH
4)
2[PtCl
6] + 2 NaCl - 3 (NH
4)
2[PtCl
6] → 3 Pt + 2 N
2 + 2 NH
4Cl + 16 HCl
塩基とも反応し、たとえば水酸化ナトリウムと反応させると[Pt(OH)6]2−を生じる[4]。
用途
[編集]ヘキサクロロ白金酸ナトリウムの1.2 MD
2O溶液は195Pt-NMRにおける化学シフト標準化合物としてもっとも一般的に用いられる。この塩は他の白金化合物にくらべて比較的安価で販売されており、溶解度も高く、スペクトルの素早い取得も可能であることからよく使われる[2]。
出典
[編集]- ^ Cox, Lawrence E.; Peters, Dennis G. (1972). “Disodium Hexachloroplatinate(IV)”. Inorganic Syntheses. 13. pp. 173–176. doi:10.1002/9780470132449.ch34. ISBN 9780470132449
- ^ a b Priqueler, Julien R. L.; Butler, Ian S.; Rochon, Fernande D. (2006). “An Overview of 195 Pt Nuclear Magnetic Resonance Spectroscopy” (英語). Applied Spectroscopy Reviews 41 (3): 185–226. Bibcode: 2006ApSRv..41..185P. doi:10.1080/05704920600620311. ISSN 0570-4928.
- ^ Kauffman, George B.; Teter, Larry A. (1963). “Recovery of Platinum from Laboratory Residues”. Inorganic Syntheses. 7. pp. 232–236. doi:10.1002/9780470132388.ch61. ISBN 9780470132388
- ^ Vasilchenko, Danila; Berdyugin, Semen; Komarov, Vladislav; Sheven, Dmitriy; Kolesov, Boris; Filatov, Evgeny; Tkachev, Sergey (2022). “Hydrolysis of [PtCl6]2− in Concentrated NaOH Solutions”. Inorg. Chem. 61 (15): 5926–5942. doi:10.1021/acs.inorgchem.2c00414. PMID 35380806.
